Сбор анамнеза заболевания
Криопирин-ассоциированные периодические синдромы. Общая информация
Криопирин-ассоциированные периодические синдромы (Сryopirin Аssociated Рeriodic Syndrome, CAPS) представлены группой врожденных аутоиммунных заболеваний, обусловленных мутациями гена NLRP3. Впервые CAPS (в частности, семейный холодовой аутовоспалительный синдром) были описаны в 1940 г. Kile и соавт. [1]. Генетическая основа CAPS установлена в 2001 г. [2].
Первое упоминание о CAPS
Установлена генетическая основа

1940
2001
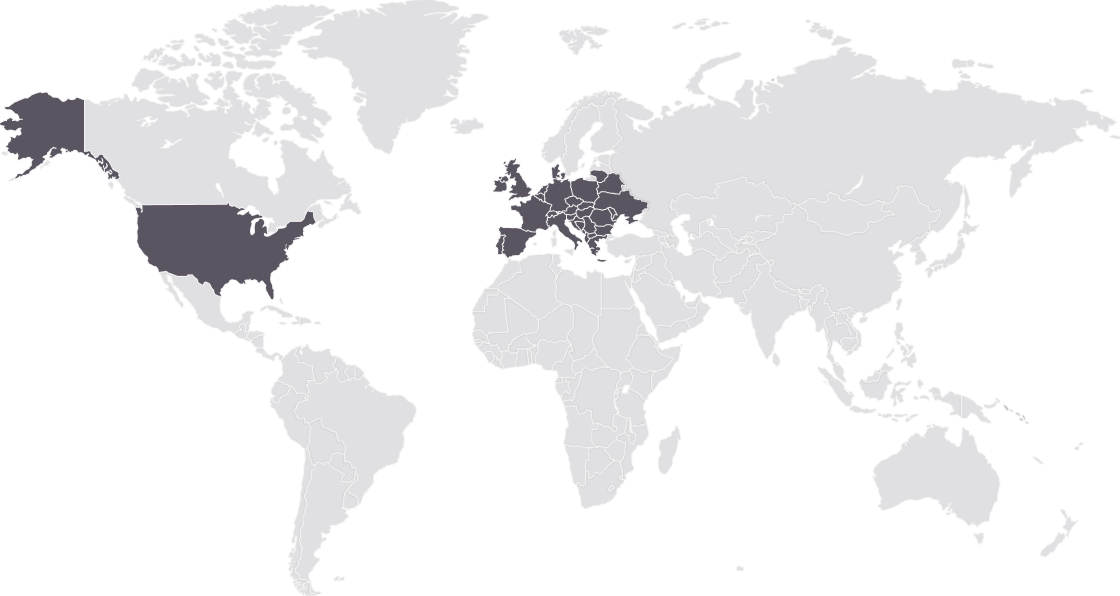
Распространенность

Этиология и патогенез

В основе развития CAPS лежат мутации гена NLRP3 (синонимы — CIAS1, NALP3 и PYPAF1), расположенного на длинном плече 1-й пары хромосом, который кодирует белок криопирин — один из ключевых факторов развития воспалительных реакций [4]. Мутации приводят к потенцированию активности криопирина и, соответственно, стимуляции аутовоспаления.
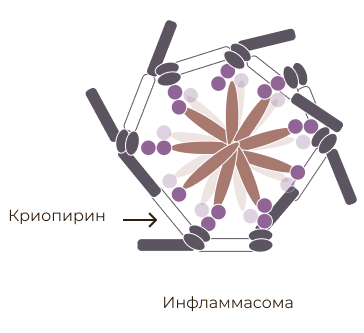





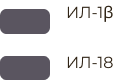
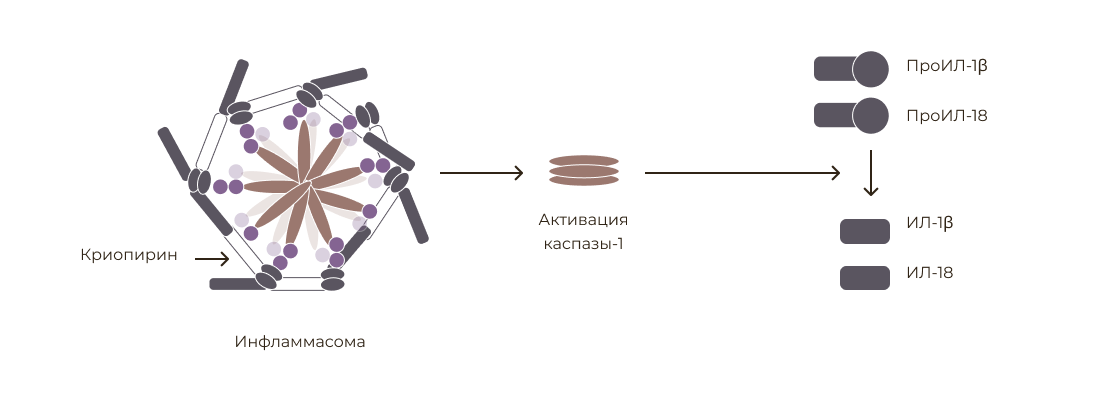
Активация ИЛ-1β с участием инфламмасомы (адаптировано из Shao et al., 2015) [9].
Другими известными активаторами инфламмасомы являются протеины вирусов и бактерий [7]. При воспроизведении CAPS в экспериментах у животных моделей с соответствующей мутацией также повышался уровень других провоспалительных цитокинов: фактора некроза опухоли, ИЛ-6, ИЛ-17, ИЛ-18 [8].
Клиническая картина
Выделяют три клинические формы CAPS [3, 10]:
Семейный холодовой аутовоспалительный синдром (FCAS)
Синдром Макла–Уэллса (Muckle–Wells Syndrome — MWS)
Хронический младенческий нервно-кожно-артикулярный синдром / младенческое мультисистемное воспалительное заболевание (Chronic Infantile Onset Neurologic Cuatneous Articular/Neonatal Onset Multisystem Inflammatory Disease — CINCA/NOMID)

В настоящее время эти состояния выделены в 3 отдельные нозологии, но ввиду общей этиологии и патогенеза, а также схожести клинических проявлений идут дискуссии, что их следует считать формами одного заболевания с различной тяжестью течения. Самым легким вариантом является FCAS, наиболее тяжелое течение характерно для CINCA/NOMID [3].
Особенности клинической картины и течения
FCAS
- Дебют в детском или взрослом возрасте
- Непродолжительные атаки от 30 минут до 72 часов
- Относительно легкое течение, амилоидоз развивается примерно у 2% пациентов
MWS
- Начало заболевания в раннем детстве или более взрослом возрасте
- Длительные (обычно 1–2 дня) эпизоды обострений
- Течение средней тяжести, амилоидоз развивается примерно в 25% случаев
CINCA/NOMID
- Перинатальный дебют
- Персистирующая симптоматика
- Тяжелое течение, при отсутствии лечения развивается амилоидоз
Общим для CAPS является мультисистемное поражение с вовлечением кожи, скелетно-мышечных структур, органов зрения и слуха, а также центральной нервной системы (ЦНС). Заболевания дебютируют, как правило, в младенчестве или раннем детском возрасте, за исключением MWS, который может манифестировать у взрослых, особенно в случаях генетического мозаицизма [3].
Лихорадка
Органы зрения
Кожа
Органы слуха
Мышцы, суставы
ЦНС
Клиническая картина складывается из проявлений острого воспаления, с течением времени присоединяются симптомы хронического воспалительного поражения внутренних органов [10, 11].
В отсутствие лечения возможны частые обострения продолжительностью от нескольких часов до нескольких дней.
Триггерными факторами обострений выступают стрессы, инфекции, депривация сна, прием алкоголя, а в случае FCAS — воздействие холода [3].
Диагностика
Выявление пациентов с CAPS в основном является прерогативой педиатров и неонатологов, но не следует забывать и о возможном дебюте в более позднем возрасте. Подозрение на CAPS, как правило, возникает при выявлении у пациентов уртикарной сыпи в сочетании с лихорадкой.
В диагностике важное значение имеют:


Аудиограмма

МРТ головного мозга

Физикальное обследование

Лабораторные исследования
(выявление нейтрофильного лейкоцитоза и повышения уровней маркеров воспаления в крови)

Инструментальное обследование
В случае, если генетическое исследование невозможно или дало отрицательный результат, следует воспользоваться диагностическими критериями международного консенсуса экспертов [10, 12].
Диагностические критерииЕсли все вышеперечисленное соответствует CAPS, то пациенту назначается генетическое тестирование на предмет выявления мутаций в гене NLRP3 [10].
Генетический проектЛечение
Прогноз зависит от тяжести заболевания и сроков начала лечения. Грозным осложнением CAPS является амилоидоз с поражением почек, который при CINCA/NOMID развивается достаточно рано. Раннее начало терапии позволяет в большинстве случаев полностью контролировать течение CAPS и их симптоматику, предупреждать поражение внутренних органов и значимо повышать качество жизни пациентов [13].

Изучение молекулярно-биологических основ развития заболевания позволило выбрать эффективные мишени для терапии. Пациенты с любым генетическим паттерном и разнообразием клинических проявлений хорошо отвечают на лечение генно-инженерными биологическими препаратами (ГИБП) [14].
Источники
- Kile R.M., Rusk H.A. A case of cold urticaria with an unusual family history. JAMA. 1940;114:1067–8.
- Hoffman H.M., Mueller J.L., Broide D.H., Wanderer A.A., Kolodner R.D. Mutation of a new gene encoding a putative pyrin-like protein causes familial cold autoinflammatory syndrome and Muckle-Wells syndrome. Nat Genet. 2001;29:301–5.
- Hashkes, Philip J., Laxer, Ronald M., Simon, Anna. Textbook of autoinflammation. Springer, 2019. ISBN 978-3-319-98605-0.
- Prieure A.-M. Molecular basis of the spectral expression of CIAS1 mutations assotiated with phagocytic cell-mediated autoinflammatory disorders CINCA/NOMID, MWS and FCU. Blood 2004;103:2809–15.
- Simon A., van der Meer J.W.М. Pathogenesis of familial periodic fever syndromes or hereditary inflammatory yndromes. Am J Physiol Regul Integr Comp Physiol 2007;292:86–98.
- Tassi S. et al. (2009) Pathogen-induced interleukin-1beta processing and secretion is regulated by a biphasic redox response. J Immunol 183(2):1456–1462.
- Kim S., Bauernfeind F., Ablasser A. et al. Listeria monocytogenes is seдругихnsed by the NLRP3 and AIM2 inflammasome. Eur. J. Immunol. 2010; 40: 1545–51.
- McGeough M.D., Wree A., Inzaugarat M.E. et al. TNF regulates transcription of NLRP3 inflammasome components and inflammatory molecules in cryopyrinopathies. J Clin Invest. 2017;127:4488–97.
- Shao, Bo-Zong & Xu, Zhe-Qi & Han, Bin-Ze & Su, Ding-Feng & Liu, Chong. (2015). NLRP3 inflammasome and its inhibitors: A review. Frontiers in Pharmacology. 6. 10.3389/fphar.2015.00262.
- Кузьмина Н.Н., Салугина С.О., Федоров Е.С. Аутовоспалительные заболевания и синдромы у детей: Учеб.-метод. пособие. — М.: ИМА-ПРЕСС, 2012.
- M. Gattorno. Cryopyrin associated periodic syndrome. Current Pediatrics. 2013; 12 (1): 57–62.
- Kuemmerle-Deschner J.B., Ozen S., Tyrrell P.N. et al. Diagnostic criteria for cryopyrin-associated periodic syndrome (CAPS). Ann Rheum Dis. 2017;76:942-7.
- Lachmann H.J., Kone-Paut I., Kuemmerle-Deschner J.B. et al. Use of canakinumab in the cryopyrin-associated periodic syndrome. N Eng J Med 2009;360(23): 2416-25.
- Goldbach-Mansky R. Blocking interleukin-1 in rheumatic diseases. Ann N Y Acad Sci. 2009;1182:111–23.


